Atomski, maseni broj, izotopi i relativna atomska masa
Atom je čestica izuzetno malih dimenzija i mase, nevidljiva golim okom ili običnim mikroskopom.
Hemijskim putem atom se ne može razložiti na jednostavnije čestice, ali atom nije jednostavne sutrukture i nije nevidljiv.
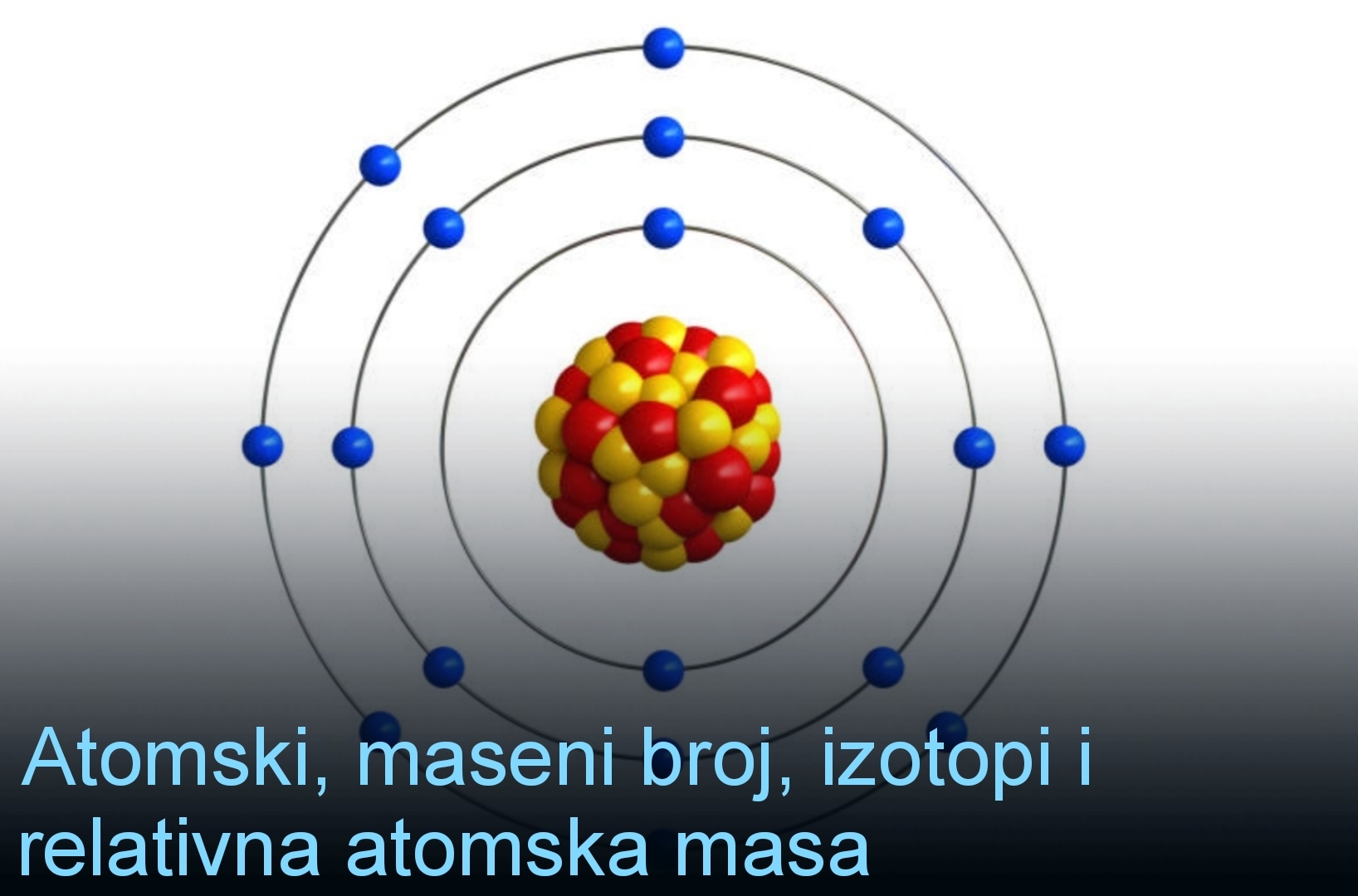
Atomi su izgrađeni od subatomskih čestica nukleona (protona i neutrona) i elektrona.
Nukleoni čine jezgro atoma, a elektroni omotač.
Atom elementa određen je njegovim atomskim (rednim) i masenim brojem.
Atomski (redni) broj jednak je broju protona u jezgru atoma
Z = N(p⁺)
Maseni broj je jednak broju nukleona (protona i neutrona) u jezgru atoma.
A = N(p⁺) + N(n°)
Broj protona u atomu jednak je broju elektrona.
N(p⁺) = N(e⁻)
Za predstavljanje atoma hemijskog elementa koristi se hemijski simbol.
To su latinični zapisi od 1 ili 2 slova koje je uveo naučnik Jeks Jakob Bercelijus.
U prirodi mogu postojati atomi istog elementa koji se razlikuju po broju neutrona i po masenom broju (A), to su izotopi.
Primer:
Vodonik (H₂) ima 3 stabilna izotopa: protijum (¹H), deuterijum (²H) i tricijum (³H)
Relativna atomska masa
Veličina važna za hemijska izračunavanja jeste relativna atomska masa.
Relativna atomska masa jeste broj koji pokazuje koliko je puta prosečna masa atoma elementa veća od 1/12 mase atoma ugljenika (¹²C).
Formula relativne atomske mase

Ukoliko su poznate zastupljenosti izotopa, može se izračunati relativna atomska masa elementa.
Primer:
Hlor (Cl) ima 2 stabilna izotopa: ³⁵C i ³⁷C, zastupljenost izotopa ³⁵C je 77,5%, a izotopa ³⁷C 22,5%. Relativna atomska masa izračunava se na osnovu sledeće formule:
Gde:
- Ar predstavlja relativnu atomsku masu.
- Procenat (%) izražava prirodni udeo izotopa u ukupnoj zastupljenosti.
Rezultat AR = 35,45 odgovara prosečnoj relativnoj atomskoj masi hlora (Cl) uzimajući u obzir zastupljenost izotopa.